Chất điện li là gì? Phân loại chất điện ly theo mức độ mạnh – yếu
Nắm vững kiến thức về chất điện li sẽ giúp các bạn học sinh làm chủ trong các dạng toán, bài tập. Hãy cùng tác giả đi tìm hiểu Sự điện li là gì? Chất điện li là gì? Độ điện li là gì? Phân loại chất điện ly mạnh yếu? để bỏ túi những lý thuyết hay tại bài viết này của Trang Tài Liệu.
Mục lục
Chất điện li là gì?
Chất điện li (tiếng Anh: “electrolyte”) là một loại chất dẫn điện có khả năng tạo ra và chứa các ion trong dung dịch hoặc trong dạng nước. Chất điện li có vai trò quan trọng trong các quá trình điện hóa và làm việc trong nhiều hệ thống điện hóa, như pin, ắc quy, điện giải, và các thiết bị điện ly.
Khi hòa tan trong nước hoặc dung dịch, chất điện li phân ly thành các ion dương và ion âm. Điện li làm cho các ion này dễ dàng di chuyển trong dung dịch hoặc giữa hai điện cực, cho phép dòng điện chạy qua.
Ví dụ, trong pin chì-axit sulfuric (ắc quy chì), dung dịch axit sulfuric (H2SO4) là chất điện li. Nó giúp tạo ra các ion H+ (cation) và SO4^2- (anion). Trong quá trình sạc pin, pin chuyển đổi các hợp chất hoá học thành chất hóa học khác, và các ion di chuyển qua dung dịch, tạo ra dòng điện trong quá trình sạc lại pin. Khi pin được sử dụng và phản ứng ngược lại, chất điện li giúp các ion di chuyển trở lại vào cấu trúc ban đầu của pin.
Chất điện li cũng được sử dụng trong nhiều ứng dụng khác nhau, chẳng hạn như trong các quá trình điện giải để tách các chất trong dung dịch, trong các phản ứng điện hóa, trong xử lý nước, và trong các thiết bị y tế.
Sự điện li là gì?
Sự điện li là quá trình phân li của các chất trong nước (hoặc khi nóng chảy). Sản phẩm của quá trình điện li của các phân tử chất điện li khi tan trong nước là các cation (ion dương) và anion (ion âm) được tách ra từ phân tử đó. Các ion này là nguyên nhân sinh ra khả năng dẫn điện của các dung dịch này.
Những chất tan trong nước (hoặc nóng chảy) phân li ra ion được gọi là những chất điện li. Hay trong một khái niệm hẹp hơn, người ta thường nói, các dung dịch dẫn được điện là chất điện li. Chất điện li chỉ có thể là các hợp chất hóa học, không thể là các nguyên tố. Ví dụ, axit, bazơ và muối là các chất điện li.
* Tính chất của chất điện li: là những chất tan được trong nước
Trong dung dịch, các hợp chất hóa học như axit, bazo và muối bị phân li (một phần hoặc toàn bộ) thành các nguyên tử (hoặc nhóm nguyên tử) tích điện gọi là ion; ion có thể chuyển động tự do trong dung dịch và trở thành hạt tải điện.
Sự phân li của một số hợp chất:
– Axit → gốc axit (ion âm) + H+ .
– Bazo → OH– (ion âm) + ion dương (kim loại).
– Muối → gốc axit (ion âm) + ion dương (kim loại).
– Một số bazo không chứa ion kim loại nhưng cũng bị phân li thành ion trong dung dịch.
Anion hay cation là phần mang điện dương của phân tử.
Phân loại chất điện li
Chất điện li được chia thành 2 loại là chất điện li mạnh và chất điện li yếu:
Chất điện li mạnh
Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion.
Chất điện li mạnh gồm các hợp chất sau:
– Các axit mạnh như: HCl, HNO3, H2SO4, HBr, HI, HClO4, HClO3 …
– Các bazơ tan như: NaOH, KOH, Ca(OH)2, Ba(OH)2 …
– Hầu hết các muối như NaCl, CuSO4, KNO3 …
Phương trình điện li của chất điện li mạnh sử dụng mũi tên 1 chiều (→).
Ví dụ:
H2SO4 → 2H+ + SO4 (2-)
KOH → K+ + OH-
Na2SO4 → 2Na+ + SO4 (2-)
Chất điện li yếu
Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử hoà tan phân li thành ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
Các chất điện li yếu gồm các hợp chất sau:
– Các axit trung bình và yếu như: H2S, H2CO3, H3PO4, HCOOH…
– Các bazơ không tan như: Mg(OH)2, Fe(OH)2, Fe(OH)3…
Phương trình điện li của chất điện li yếu sử dụng 2 mũi tên ngược chiều ( ⇌ ).
VÍ dụ:
H2S ⇌ H+ + HS-
Sự điện li của chất điện li yếu được đánh giá bằng đại lượng độ điện li α:
α = số phân tử phân li/tổng số phân tử hoà tan
Độ điện li là gì?
– Để biểu thị mức độ phân li ra ion của các chất điện li, ta dùng khái niệm độ điện li
+ Độ điện li α ( anpha) của một chất điện li là tỷ số giữa phân tử phân li thành ion (n) và tổng số phân tử hòa tan (no).
Ta có 0 ≤ α ≤ 1 Hay 0% ≤ α ≤ 100%
Chất không điện li tức là không bị phân li: α = 0
Chất điện li mạnh thì sự phân li hoàn toàn: α = 1 hay 100%
Chất điện li yếu thì sự phân li không hoàn toàn 0 < α < 1
Vậy ta có thể phát biểu cách khác: Ở cùng một nhiệt độ và cùng nồng độ mol/lít chất điện li càng mạnh thì độ điện li α càng lớn.
+ Tỷ lệ phân tử cũng là tỷ lệ số mol, nên α bằng tỷ số phần nồng độ mol chất tan phân li thành Cp và tổng nồng độ mol của chất tan trong dung dịch Ct:
Biểu thức:
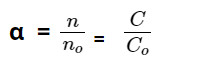
Với: n là số phân tử phân li ra ion, nolà số phân tử hòa tan.
C là nồng độ mol chất tan phân li thành ion, Co là nồng độ mol chất hòa tan.
Độ điện li α phụ thuộc vào:
– Bản chất của chất tan.
– Bản chất của dung môi.
– Nhiệt độ
– Nồng độ chất điện li.
Một số bài tập vận dụng về sự điện li
Bài tập 1: (Bài 1 trang 7 Sách giáo khoa Hóa học lớp 11) Các dung dịch axit như HCl, bazơ như NaOH và muối như NaCl dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện được là do nguyên nhân gì?
Hướng dẫn giải:
Trong dung dịch: Các axit, các bazơ, các muối phân li ra các ion dương và ion âm chuyển động tự do nên dung dịch của chúng có khả năng dẫn điện.
Thí dụ:
HCl → H+ + Cl-
NaOH → Na+ + OH-
NaCl → Na+ + Cl-
Còn các dung dịch như ancol etylic, đường saccarazơ, glixerol không dẫn điện vì trong dung dịch chúng không phân li ra các ion dương và ion âm.
Bài tập 2: (Bài 3 trang 7 Sách giáo khoa Hóa học lớp 11) Viết phương trình điện li của những chất sau:
a) Các chất điện li mạnh: Ba(NO3)2 0,10M; HNO3 0,020M; KOH 0,010M. Tính nồng độ mol của từng ion trong dung dịch.
b) Các chất điện li yếu HClO; HNO2.
Hướng dẫn giải:
a) Các chất điện li mạnh:
Ba(NO3)2 → Ba 2+ + 2 NO3 −
0,10 0,10 0,20 ( M )
→ [Ba2+] = 0,1M; [NO3 −] = 0,2M
HNO3 → H + + NO3 −
0,020 0,020 0,020 M
→ [H+] = [ NO3 − ] = 0,02M
KOH → K + + OH −
0,010 0,010 0,010 M
→ [K+] = [OH-] = 0,010M
b) Các chất điện li yếu:
HClO ⇌ H+ + ClO-
HNO2 ⇌ H+ + NO2 −
Bài tập 3: (Bài 4 trang 7 Hóa học lớp 11) Chọn câu trả lời đúng trong các câu sau đây: Dung dịch chất điện li dẫn được điện là do:
A. Sự dịch chuyển của các electron.
B. Sự dịch chuyển của các cation.
C. Sự dịch chuyển của các phân tử hoà tan.
D. Sự dịch chuyển của cả cation và anion.
Hướng dẫn giải:
Chọn đáp án D. Do khi hoà tan (trong nước) các phân tử chất điện li phân li ra thành các cation và anion.
Bài tập 4: (Bài 5 trang 7 hóa học lớp 11) Chất nào sau đây không dẫn điện được?
A. KCl rắn, khan. B. CaCl2 nóng chảy. C. NaOH nóng chảy. D. HBr hoà tan trong nước.
Hướng dẫn giải:
Chọn đáp án A. Do KCl rắn, khan tồn tại dưới dạng mạng tinh thể ion, rất bền vững. Không phân li ra được ion dương và ion âm (di chuyển tự do) nên không có khả năng dẫn điện.
Bài tập 5: Trộn 200 ml dung dịch chứa 12 gam MgSO4 với 300 ml dung dịch chứa 34,2 gam Al2(SO4)3 thu được dung dịch X. Nồng độ ion SO4 (2-) trong X là:
A. 0,2M. B. 0,8M. C. 0,6M. D. 0,4M.
Hướng dẫn giải:
Đáp án: B Giải thích:
n MgSO4 = 0,1 mol
n Al2(SO4)3 = 0,1 mol
⇒ ∑ n SO2(2-) = n MgSO4 + 3 nAl2(SO4)3 = 0,4 mol
⇒ [SO4(2-)] = 0,4 / (0,2 + 0,3) = 0,8 M
Bài tập 6: Một dung dịch chứa các ion: Cu2+ (0,02 mol), K+ (0,10 mol), (0,05 mol) và (x mol). Giá trị của x là:
A. 0,050. B. 0,070. C. 0,030. D. 0,045.
Hướng dẫn giải:
Đáp án: D
Giải thích: Áp dụng bảo toàn số mol điện tích ta có:
2n Cu(2+) + n K+ = n NO3- + 2 nSO4(2-)
=> 2.0,02 + 0,1 = 0,05 + 2x
=> x = 0,045 mol
Bài tập 7: Chất nào sau đây là chất điện li mạnh?
A. NaCl B. CH3COOH C. H2O D. HF
Hướng dẫn giải:
Chọn đáp án A. NaCl
Các chất còn lại là chất điện li yếu do khi điện li, chỉ có một số phân tử hoà tan phân li thành ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
Bài tập 8: Chất nào dưới đây thuộc loại chất điện li?
A. Glucozơ. B. Ancol etylic. C. KCl D. axeton.
Hướng dẫn giải: Chọn đáp án C. KCl do KCl là muối tan -> chất điện li.
Bài tập 9: Dãy chất nào dưới đây chỉ gồm những chất tan và điện li mạnh?
A. HNO3, Cu(NO3)2, Ca3(PO4)2, H3PO4
B. H2SO4, NaCl, KNO3, Ba(NO3)2
C. CaCl2, CuSO4, CaSO4, HNO3
D. KCl, H2SO4, H2O, CaCl2
Hướng dẫn giải:
Chọn đáp án B. H2SO4, NaCl, KNO3, Ba(NO3)2
Giải thích:
A loại vì Ca3(PO4)2 là chất không tan trong nước và H3PO4 là chất điện li yếu.
C loại vì CaSO4 ít tan trong nước.
D loại vì H2O là chất điện li yếu.
Bài tập 10: Trong số các chất sau: HNO2, CH3COOH, KMnO4, C6H6, HCOOH, HCOOCH3, C6H12O6, C2H5OH, SO2, Cl2, NaClO, CH4, NaOH, NH3, H2S. Số chất thuộc loại chất điện li là:
A. 8 B. 7 C. 9 D. 10
Hướng dẫn giải:
Chọn đáp án B. 7 chất
Giải thích: Các chất điện li gồm: HNO2, CH3COOH, HCOOH, KMnO4, NaClO, NaOH, H2S.
Bài tập 11: Chất nào sau đây là chất điện li mạnh:
A. HCl. B. CH3COOH. C. Al(OH)3. D. C6H12O6.
Hướng dẫn giải:
Chọn đáp án A. HCl do HCl là một axit mạnh, tan trong nước nên là chất điện li mạnh.
Trên đây là nội dung trình bày của Trang Tài Liệu về Sự điện li và phân loại chất điện li trong chương trình hóa học và vật lý phổ thông. Nếu thấy nội dung bài viết này hữu ích thì bạn đừng quên theo dõi website của chúng tôi để cập nhật thêm nhiều khái niệm thú vị khác.






