Bảng tuần hoàn hóa học lớp 8 cập nhật mới nhất 2022
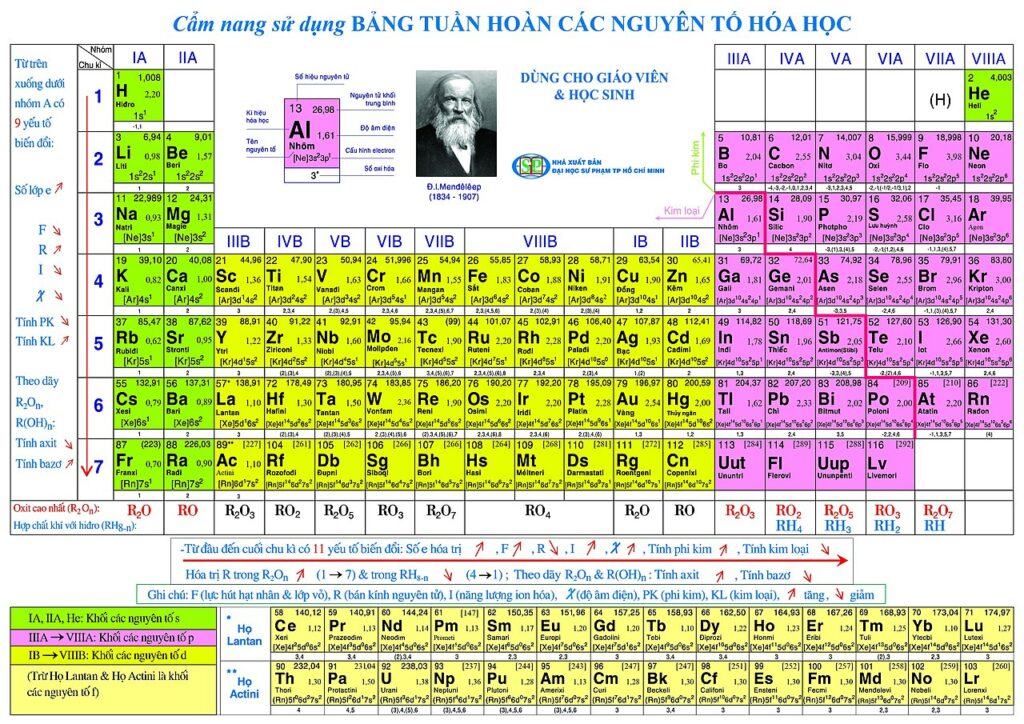
Bảng tuần hoàn hóa học của Mendeleev là số hiệu nguyên tử hay số proton hạt nhân của các nguyên tố. Đây được coi là phương pháp để liệt kê các nguyên tố dưới dạng bảng, được sắp xếp theo số nguyên tử, chu kỳ hóa học và cấu hình electron của chúng.
Mục lục
Trong bảng tuần hoàn các nguyên tử sẽ được sắp xếp theo thứ tự tăng dần ghi kèm theo ký tự hóa học của mỗi ô. Do đó mà một bảng tuần hoàn hóa học chuẩn sẽ được sắp xếp thành 18 cột, 7 hàng cùng 2 hàng kép riêng biệt ở dưới cùng.
Dưới đây là bài viết tổng hợp kiến thức cơ bản về bảng tuần hoàn hóa học dành cho các em học sinh bắt đầu học môn hóa. Đồng thời Trangtailieu cũng chia sẻ những mẹo học thuộc bảng tuần hoàn một cách nhanh chóng nhất.
Ảnh bảng tuần hoàn các nguyên tố hóa học lớp 8
Cấu tạo bảng tuần hoàn hóa học
Ô nguyên tố
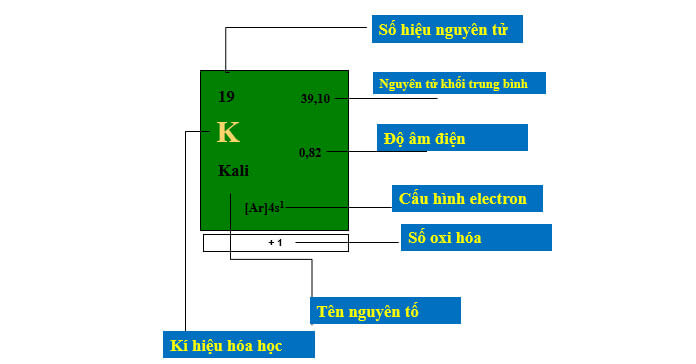
- Số hiệu nguyên tử cho biết số hạt proton của một nguyên tố trong hạt nhân nguyên tử. Con số này cũng chính là số điện tích hạt nhân của nguyên tử nguyên tố đó. Vì số hiệu nguyên tử của một nguyên tố là duy nhất nên dựa vào số hiệu này ta xác định được tên nguyên tố cần tìm. Ngoài ra, khi một nguyên tử không tích điện, số lượng electron trong lớp vỏ sẽ bằng số hiệu nguyên tử.
- Nguyên tử khối trung bình là khối lượng trung bình của hỗn hợp các đồng vị của nguyên tố đó theo phần trăm nguyên tử đã cho.
- Độ âm điện của một nguyên tố hóa học là khả năng các nguyên tử của nguyên tố đó hút electron để hình thành liên kết hóa học. Do đó, độ âm điện của nguyên tử nguyên tố càng lớn thì tính phi kim càng mạnh, ngược lại, độ âm điện của nguyên tử càng nhỏ thì tính phi kim càng nhỏ hay tính kim loại càng mạnh.
- Cấu hình electron còn gọi là cấu hình điện tử, nguyên tử thể hiện sự phân bổ của các electron có trong lớp vở nguyên tử nguyên tố đó khi ở những trạng thái năng lượng khác nhau.
- Số oxi hóa cho ta biết số electron mà một hay nhiều nguyên tố sẽ trao đổi với nguyên tử nguyên tố khác khi tham gia vào một phản ứng oxi hóa khử.
Chu kỳ
- Một chu kỳ sẽ là một hàng ngang trong bảng tuần hoàn. Trong một chu kì bắt đầu từ trái sang phải, bán kính nguyên tử sẽ giảm dần do mỗi nguyên tố thêm vào proton sẽ khiến cho electron lớp ngoài bị kéo gần hạt nhân hơn. Bán kính của nguyên tử giảm sẽ làm năng lượng ion hóa và độ âm điện tăng dần. Áp lực electron cũng ít nhiều có một xu hướng với kim loại thường có áp lực electron thấp hơn phi kim với ngoại lệ là các khí hiếm.
- Số thứ tự của chu kỳ trùng với số lượng lớp electron của nguyên tử các nguyên tố trong chu kì đó. Chu kì nhỏ gồm chu kỳ 1,2,3. Chu kì lớn gồm chu kỳ 4,5,6,7.
Nhóm nguyên tố trong bảng hệ thống tuần hoàn
- Nhóm nguyên tố là tập hợp của các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần như nhau và được sắp xếp thành một cột.
- Chỉ có 2 loại nhóm nguyên tố là nhóm A và nhóm B.
Nhóm A bao gồm các nguyên tố s và p. Số thứ tự nhóm A bằng tổng số e lớp ngoài cùng.
Nhóm B sẽ bao gồm các nguyên tố d và f có cấu hình e nguyên tử tận cùng dạng (n-1) dxnsy:
* Nếu (x+y) = 3 -> 7 thì nguyên tố thuộc nhóm (x+y) B
* Nếu (x+y) = 8 -> 10 thì nguyên tố thuộc nhóm VIIB
* Nếu (x+y) > 10 thì nguyên tố thuộc nhóm (x+y – 10)B.
- Khối các nguyên tố s,p,d,f
Khối các nguyên tố s gồm các nguyên tố nhóm IA và IIA là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s. Ví dụ: 11Na
Khối các nguyên tố p gồm các nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He) là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p. Ví dụ: 13Al
Khối các nguyên tố d gồm những nguyên tố thuộc nhóm B là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d. Ví dụ: 26Fe.
Khối các nguyên tố f gồm có các nguyên tố thuộc họ Lantan và Actini là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
Cách học thuộc bảng tuần hoàn hóa học lớp 8 đơn giản
Nhóm IA : H- Li- Na- K- Rb- Cs- Fr sẽ là Lính nào không rượu cà phê
Nhóm IIA: Be- Mg- Ca- Sr- Ba- Ra sẽ thành Bé Mang Cá Sang Bà Rán
Nhóm IIIA: B- Al- Ga- In- Tl sẽ thành Ba Anh Lấy Gà Trong(In) Tủ lạnh
Nhóm IV: C- Si- Ge- Sn- Pb sẽ thành Cô Sinh Ghé Sang Phố
Nhóm V: N- P- As- Sb- Bi thành Ni cô Phàm tục Ắt Sầu Bi
Nhóm VI: O- S- Se- Te- Po thành Ông Say Sưa Táp Phở
Nhóm VII: F- Cl- Br- I- At thành Phải Chi Bé Iu Anh
Nhóm VIII: He- Ne- Ar- Kr- Xe- Rn thành Hằng Nga Ăn Khúc Xương Rồng
Các nguyên tố từ 1 đến 20: H – He – Li – Be – B – C – N – O – F – Ne – Na – Mg – Al – Si – P – S – Cl – Ar – K – Ca sẽ thành:
Hoàng hôn lặn bể Bắc
Chợt nhớ ở phương Nam
Nắng mai ánh sương phủ
Song cửa ai không cài
Hy vọng những kiến thức cơ bản về bảng tuần hoàn hóa học lớp 8 cùng những mẹo học nhanh nhớ lêu mà Trangtailieu.com cung cấp sẽ giúp ích cho bạn trong hành trình chinh phục đại dương kiến thức






